Tárgy savas és bázikus szerves vegyületek
A forma a diákok jobban megértsék a hatását sav-bázis tulajdonságai szerves vegyületek, sok fizikai-kémiai és biológiai eljárások a körülmények a test.
Teach diákok, hogy meghatározzuk a sav-bázis tulajdonságaiban az alkoholok, fenolok, tiolok és aminok, szerkezetüktől függően.
A diák tudnia kell: milyen típusú savak és Brönsted bázisok.
A hallgató képesnek kell lennie: meghatározni a savas és bázikus tulajdonságait szerves vegyületek.
Modern ötleteket savak és lúgok. Brønsted és Lowry
Fontos szempontok a reakciót szerves vegyületek azok a savas és bázikus tulajdonságokkal. Ahhoz, hogy írják le a savas és bázikus tulajdonságai kémiai vegyületek számos elmélet létezik - Brönsted és Lowry elmélet, Lewis elmélet és számos más. A leggyakoribb az elmélet Brønsted és Lowry, vagy Protolytic elmélet.
Szerint a Bronsted-elmélet - Lourikisloty - egy semleges molekula vagy ion, amely képes protont (proton donorok), és a bázis - semleges molekulák vagy ionok kapcsolni képes proton (proton-akceptorok).
Szerint a Lewis-elmélet savak - vannak semleges molekulák vagy ionok kapcsolni képes egy elektronpár (elektronpár-akceptor), és a bázis - semleges molekulák vagy ionok adására képes egy elektronpárt (elektronpár donorok).
Ez azt jelenti, hogy elméletileg, bármilyen vegyület, amely magában foglalja a hidrogénatom, ez adhat egy proton és mutatnak a sav tulajdonságainak. Az a képesség, hogy protont mutathatnak nem csak egy semleges molekula, de töltött részecskék - kationok (NH4 +) és anionjai savak, például HCI, ROH, HSO4 - és mások.
hordozó részecskéket egy negatív töltés, például C1 - Szerepe a bázis anionok működhet -. OH -. HSO4. NH3. A bázisok lehetnek semlegesek molekulák, amelyek magukban foglalják egy heteroatom, például nitrogén-, kén-, oxigénatom, tartalmazó osztatlan elektronpárt, például ROH alkoholok.
Semleges molekulák vagy ionok képesek, jellegétől függően a második alkotórészek tulajdonságai savakat vagy bázisokat nevezzük amfoter.
Az elmélet a Brönsted - Lowry. Konjugátum savak és bázisok.
Savak és bázisok mutatnak azok tulajdonságait csak jelenlétében egymást, egyik sem veschesvto nem protont, ha a rendszer nincs protonakceptor - bázis és naoborot.t.e. alkotnak konjugált sav-bázis pár, amelyben az erősebb sav, a gyengébb van annak konjugált bázisa, és erősebb a bázis, annál gyengébb a konjugált sav.
Reagáltattuk, és így egy proton alakítjuk a konjugált bázis és egy proton megkötő bázis, alakítjuk konjugált sav. A savat általában jelöljük AN, és a bázis - a
Például: NS1↔ H + C1 + -. HC1 - erős sav; C1 - ion - konjugált gyenge bázis;
CH 3 COOH ↔ CH 3 COO - + H +. CH3COOH - gyenge sav, és a CH 3 COO - - erős bázis ion konjugátum.
a-ta bázisok interfész. interfész.
Már mondta, hogy a savas vegyületek tulajdonságainak találhatók csak a bázis jelenlétében, és az alapvető tulajdonságokat - a sav jelenlétében, azaz, Létezik bizonyos vegyületek a sav - bázis egyensúly, a tanulmány, amelyet oldószerként használt H2 O. tekintetében H2O például sav vagy bázis meghatározzák a sav-bázis vegyületek tulajdonságait.
A gyenge elektrolitok savasságát mennyiségileg Kraw reakció, amely abból áll, átvitelére H + a sav H2 O, mint a bázis.
-ta th bázis alapjait savval
CH 3 COO - - acetát ion, konjugált bázis;
H3 O + - hidrónium ionok, a konjugált sav.
Értékét használva az egyensúlyi állandója e reakció, és az a tény, hogy a koncentrációja N2 O csaknem állandó, lehetséges, hogy meghatározzuk a termék K · [H2 O] nevezett Kkislotnosti savasságot konstans (Ka).
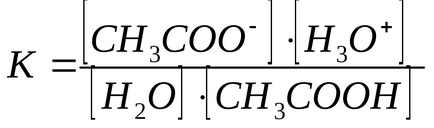
Minél nagyobb a Ka. annál erősebb a sav. A CH3COOH Ka = 1,75 × 10 -5. az ilyen kis mennyiségek kényelmetlen gyakorlati működése, tehát kifejezett Ka pKa (pKa = -ℓgKa). A CH3COOH pK a = 4,75. Minél kisebb a pK. annál erősebb a sav.
A szilárdságot úgy határoztuk meg a bázisok rKVN +.